czym jest
Tętniak mózgu?
diagnostyka tętniaka wewnątrzczaszkowego
definicja
Tętniak wewnątrzczaszkowy (tętniak tętnic mózgowych, w uproszczeniu zwany tętniakiem mózgu) jest lokalnym, nieprawidłowym poszerzeniem tętnicy mózgowej, najczęściej zlokalizowanym na podziale naczynia lub na jego krzywiźnie.
metody leczenia
Tętniak mózgu może być zaopatrzony chirurgicznie lub endowaskularnie (przeznaczyniowo).
objawy tętniaka
Większość tętniaków naczyń mózgowych pozostaje klinicznie bezobjawowa aż do momentu pęknięcia i spowodowania krwawienia podpajęczynówkowego.
powszechność
Częstość występowania tętniaków wewnątrzczaszkowych w populacji krajów zachodnich szacuje się na około 2%.
dlaczego tętniak się rozwija?
Niestety nadal nie znamy jednoznacznej odpowiedzi. W przeszłości patologia ta rozpatrywana była jako wrodzona, co nie korelowało z faktem, iż jedynie wyjątkowo spotyka się ją u dzieci, czy tym bardziej u niemowląt. Obecnie przeważa pogląd o jej nabytym charakterze. Postuluje się kombinację czynników hemodynamicznych oraz nieprawidłowości budowy ściany tętnicy. W warunkach podwyższonego stresu hemodynamicznego następuje ogniskowe, miejscowe poszerzenie ściany tętnicy, które może się następnie ustabilizować lub też, gdy niekorzystne warunki są utrzymywane, powodować wzrost tętniaka a w najgorszym przypadku jego pęknięcie. Ściana tętniaka, w porównaniu do ściany nieuszkodzonej tętnicy, jest niepełnowartościowa, pozbawiona prawidłowo występujących warstw – błony środkowej oraz błony sprężystej wewnętrznej. Jej wytrzymałość mechaniczna jest zatem wyraźnie obniżona, co w konsekwencji rodzi wyższe ryzyko jej przerwania i krwawienia z tętniaka. Czynnikiem towarzyszącym i poprzedzającym pęknięcie tętniaka jest reakcja zapalna i napływ komórek zapalnych w obręb ściany tętniaka. To spostrzeżenie prowadzi do istotnych wniosków praktycznych, a mianowicie sugeruje, że zobrazowanie techniką rezonansu magnetycznego cech zapalenia ściany tętniaka może stanowić argument przy podejmowaniu decyzji, których pacjentów z tętniakiem niepękniętym należy poddać pilnemu leczeniu. Póki co jednak metoda ta nie gwarantuje pożądanej swoistości stąd nie weszła do kanonu postępowania diagnostycznego. Być może jest to pieśń niedalekiej przyszłości.
Niestety na dzień dzisiejszy nie dysponujemy żadną techniką pozwalającą nam jednoznacznie stwierdzić jak wysokie jest ryzyko pęknięcia danego tętniaka u konkretnego pacjenta.
Jakie jest ryzyko pęknięcia tętniaka naczyń mózgowych?
aTo jedno z najczęstszych pytań zadawanych przez pacjentów i zarazem jedno z najtrudniejszych by udzielić jednoznacznej i rzetelnej odpowiedzi. Na podstawie fachowej literatury światowej opartej o opracowania statystyczne wiemy, że prawdopodobieństwo pęknięcia tętniaka naczynia mózgowego jest skorelowane z jego wielkością, lokalizacją oraz dodatnim wywiadem przebytego krwawienia podpajęczynówkowego. Zgodnie z wynikami dużego badania prospektywnego International Study of Unruptured Intracranial Aneurysms (ISUIA), dla pięcioletniego okresu obserwacji łączne ryzyko pęknięcia tętniaka mniejszego niż 7mm, zlokalizowanego w przedniej części koła Willisa jest bardzo niskie i wynosi 0,05%, a położonego w tylnej części koła tętniczego – 2,5%. Przy czym do tylnego krążenia zaliczono również tętniaki tętnicy szyjnej wewnętrznej przy odejściu tętnicy łączącej tylnej (ICA/Pcom). Wyniki te spotkały się z dużą falą krytyki z uwagi na zauważalną w codziennej praktyce klinicznej istotną ilość pacjentów przyjmowanych do szpitala z powodu pęknięcia tętniaka wewnątrzczaszkowego wielkości poniżej 7mm. Główne zarzuty dotyczyły znacznego niedoszacowania w ramach badania tętniaków kompleksu tętnicy łączącej przedniej, które z niewiadomych przyczyn często pękają przy relatywnie niewielkich rozmiarach oraz uwzględnienia tętniaków odcinka jamistego tętnicy szyjnej wewnętrznej, które nierzadko osiągają duże rozmiary i z zasady nie powodują krwawienia podpajęczynówkowego (tylko przetokę szyjno-jamistą – zdarzenie klinicznie istotne, ale mniej groźne niż SAH).
Badanie The Natural Course of Unruptured Cerebral Aneurysms in a Japanese Cohort (UCAS Japan) wykazało wyższe niż w ISUIA ryzyko pęknięcia tętniaków tętnicy łączącej przedniej (Acom) i łączącej tylnej (ICA/Pcom) oraz wyróżniło nieregularny kształt worka tętniaka jako dodatkowy czynnik zwiększający ryzyko jego pęknięcia .
Kilka lat temu opublikowano meta-analizę szacującą ryzyko pęknięcia tętniaka wewnątrzczaszkowego na podstawie blisko trzydziestu tysięcy osobo-lat obserwacji. Czynnikami ryzyka pęknięcia tętniaka w powyższej analizie były: wiek, nadciśnienie tętnicze, przebyty SAH, wielkość i lokalizacja tętniaka oraz pochodzenie geograficzne pacjenta. Z uwagi na niepełne dane w szacunkach nie uwzględniono palenia papierosów ani kształtu worka tętniaka. Zgodnie z wynikami cytowanej pracy całkowite pięcioletnie ryzyko pęknięcia tętniaka obliczone w oparciu o sześć wyżej wymienionych czynników waha się pomiędzy 0,3% a 15%. Uwaga: nie próbuj proszę uzyskać wartości ryzyka dla dłuższego niż pięcioletni okresu obserwacji poprzez zwykłą ekstrapolację powyższych danych.
W codziennej praktyce, rozważając podjęcie leczenia u danego pacjenta posiłkujemy się opracowanymi skalami ryzyka pęknięcia tętniaka. Musisz mieć jednak świadomość, że żadna skala nie informuje w sposób jednoznaczny i nie gwarantuje stu procentowej pewności co do słuszności oceny.
Czy tętniak mózgu jest zjawiskiem powszechnym?
Częstość występowania tętniaków wewnątrzczaszkowych w populacji krajów zachodnich szacuje się na około 2%. Zauważono predyspozycję genetyczną do rozwoju tętniaka, jednak nie udało się do tej pory wykazać specyficznych genów związanych z jego formowaniem się czy pęknięciem. Jedynymi niezależnymi czynnikami powstawania tętniaków wewnątrzcząsteczkowych są palenie papierosów, nadciśnienie tętnicze i płeć żeńska. Istnieje natomiast zwiększona częstość rodzinnego występowania tętniaków. Około 20% pacjentów z tętniakiem naczyń mózgowych i 10% pacjentów z krwawieniem podpajęczynówkowym z powodu pęknięcia tętniaka posiada dodatni wywiad rodzinny (co najmniej dwóch krewnych w pierwszej linii obciążonych występowaniem tętniaka naczynia mózgowego). Wyższą predylekcję do tej jednostki chorobowej wykazują również pacjenci cierpiący na wielotorbielowatość nerek dziedziczoną autosomalnie dominująco, typ 2 i 4 zespołu Ehlersa-Danlosa, koarktację aorty czy dysplazję włóknisto-mięśniową. Stanowią oni jednak tylko znikomy odsetek pacjentów z tętniakiem mózgu spotykanych w codziennej praktyce.
W jaki sposób wykryć tętniaka mózgu?
Do podstawowych metod obrazowych używanych w diagnostyce tętniaków należą cyfrowa angiografia subtrakcyjna (DSA), angiografia tomografii komputerowej (CTA) oraz angiografia rezonansu magnetycznego (MRA). Cel przeprowadzanego badania stanowi wykrycie tętniaka, ocena jego szyi, morfologii oraz stosunku do otaczających go naczyń.
DSA jest techniką zabiegową, wymagającą nakłucia tętnicy (najczęściej udowej wspólnej (pachwina) lub promieniowej (nadgarstek). CTA i MRA to badania nieinwazyjne z wykorzystaniem odpowiednio tomografii komputerowej lub rezonansu magnetycznego.
Czułość i swoistość CTA w wykrywaniu tętniaka wewnątrzczaszkowego wynosi odpowiednio 77-79% i 87-100%, jednak należy wziąć pod uwagę, iż wyraźnie obniża się ona wraz ze spadkiem wielkości tętniaka. Dla tętniaków mniejszych niż 3mm czułość CTA waha się w granicach 40-90%. Podobny spadek czułości tyczy się również MRA. Z praktycznego punktu widzenia istotną informację stanowi fakt, iż by wykonać CTA konieczne jest dożylne podanie pacjentowi środka kontrastowego zawierającego jod. Jeśli jesteś uczulony na jod – nie możesz mieć prowadzonej diagnostyki tą metodą lub konieczne jest zachowanie dodatkowych środków ostrożności. Decyzję podejmuje lekarz w porozumieniu z Tobą. Angiografia rezonansu magnetycznego działa na innych zasadach (pozwolisz, że pominiemy skomplikowane podstawy fizyczne ;-)). Uzyskanie obrazu naczyń mózgowych w tej technice nie wymaga podawania środka kontrastowego. Dla Twojej informacji jeszcze jedna istotna uwaga – środki kontrastowe stosowane w rezonansie magnetycznym (jeśli masz inne wskazania do jego zastosowania) są oparte o odmienne związki chemiczne niż w tomografii komputerowej i nie zawierają jodu.
Jak dzielimy tętniaki naczyń mózgowych?
Dokonano licznych kwalifikacji i podziałów tętniaków, między innymi ze względu na kształt (workowate, wrzecionowate), etiologię (infekcyjne, rozwarstwiające, prawdziwe), wielkość czy lokalizację. Na potrzeby tej strony zawęzimy pojęcie tętniaka wewnątrzczaszkowego do tętniaków prawdziwych, workowatych, które to są najczęściej spotykane.
Większość tętniaków wewnątrzczaszkowych (około 85-95%) zlokalizowanych jest w przedniej części koła tętniczego Willisa, podczas gdy tylko 5-15% znajduje się w tylnym krążeniu.
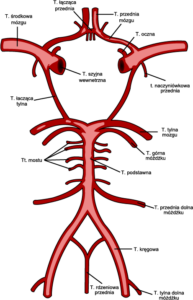
Do najczęstszych lokalizacji należą: kompleks tętnicy łączącej przedniej mózgu (Acom – 30%), tętnica szyjna wewnętrzna przy odejściu tętnicy łączącej tylnej (ICA/Pcom – 25%) i tętnica środkowa mózgu (MCA – 20%). W tylnej części koła tętniczego Willisa dominującą lokalizację stanowi tętnica podstawna (BA). U około 20-30% pacjentów wykrywa się tętniaki mnogie.
objawy tętniaka wewnątrzczaszkowego i krwawienie podpajęczynówkowe
Zdecydowana większość tętniaków naczyń mózgowych pozostaje klinicznie bezobjawowa aż do momentu pęknięcia i spowodowania krwawienia podpajęczynówkowego (SAH), które to jest najczęstszą kliniczną manifestacją tętniaka mózgu. Oznacza to, że zdecydowana większość pacjentów z niepękniętym tętniakiem mózgu nie ma z tego tytułu żadnych symptomów i najczęściej dowiaduje się o jego istnieniu przypadkowo, wykonując badania obrazowe naczyń mózgowych z innych wskazań, jak ból czy zawroty głowy.
Występowanie krwawienia podpajęczynówkowego w zachodniej populacji szacuje się na 6-10 przypadków na 100000 osób rocznie, ze szczytem przypadającym na szóstą dekadę życia . Rokowanie w przypadku SAH jest poważne. Śmiertelność waha się w przedziale 27-44%. W ostatnich latach w krajach zurbanizowanych, dzięki poprawie metod diagnostycznych i terapeutycznych, notuje się stały spadek śmiertelności o około 0,8% na rok. Szansa na przeżycie i niezależne, samodzielne funkcjonowanie wynosi po roku od epizodu SAH między 69 a 76% w zależności od metody leczenia.
Celem uniwersalnego i jednolitego sposobu określania stanu klinicznego pacjenta z krwawieniem podpajęczynówkowym stworzonych zostało kilka skal. Do zdecydowanie najczęściej stosowanych należy skala Hunta-Hessa.
Skala Hunta-Hessa
| Stopień | Objawy/ stan kliniczny pacjenta |
| 1 | Bezobjawowy lub niewielki ból głowy |
| 1a | Deficyt neurologiczny bez zespołu oponowego |
| 2 | Umiarkowany bądź silny ból głowy, objawy oponowe, objawy uszkodzenia nerwów czaszkowych |
| 3 | Splątanie, senność, objawy ogniskowe |
| 4 | Niedowład połowiczy, stupor, zaburzenia wegetatywne |
| 5 | Głęboka śpiączka, sztywność odmóżdżeniowa, prężenia |
Zwróć proszę uwagę na objawy związane z pęknięciem tętniaka mózgu zawarte w tabeli. Dominujący stanowi nagły, silny ból głowy, często określany bólem piorunującym, nigdy wcześniej nie odczuwanym przez pacjenta.
Wykazano istotny wpływ na rokowanie u chorych z krwawieniem podpajęczynówkowym w zależności od wieku pacjenta oraz jego stanu klinicznego przy przyjęciu. Wyjściowy ciężki stan kliniczny pacjenta określony jako stopień IV lub V w skali Hunta-Hessa uznano za niezależny zły czynnik rokowniczy z prawdopodobieństwem korzystnego efektu końcowego leczenia u odpowiednio 62% i 25% chorych.
literatura (diagnostyka, metody leczenia i embolizacja)
- Tulamo R, Frösen J, Junnikkala S, Paetau A, Pitkäniemi J, Kangasniemi M, Niemelä M, Jääskeläinen J, Jokitalo E, Karatas A, Hernesniemi J, Meri S.: Complement activation associates with saccular cerebral artery aneurysm wall degeneration and rupture. Neurosurgery. 2006 Nov;59(5):1069-76.
- Frösen J, Piippo A, Paetau A, Kangasniemi M, Niemelä M, Hernesniemi J, Jääskeläinen J. : Remodeling of saccular cerebral artery aneurysm wall is associated with rupture: histological analysis of 24 unruptured and 42 ruptured cases. Stroke.. 2004 Oct;35(10):2287-93.
- Matouk CC, Mandell DM, Günel M, Bulsara KR, Malhotra A, Hebert R, Johnson MH, Mikulis DJ, Minja FJ. : Vessel wall magnetic resonance imaging identifies the site of rupture in patients with multiple intracranial aneurysms: proof of principle. Neurosurgery. 2013 Mar;72(3):492-496.
- Nagahata S, Nagahata M, Obara M, Kondo R, Minagawa N, Sato S, Sato S, Mouri W, Saito S, Kayama T. : Wall Enhancement of the Intracranial Aneurysms Revealed by Magnetic Resonance Vessel Wall Imaging Using Three-Dimensional Turbo Spin-Echo Sequence with Motion-Sensitized Driven-Equilibrium: A Sign of Ruptured Aneurysm? Clin Neuroradiol. 2014 Oct 21.
- Wiebers DO, Whisnant JP, Huston J 3rd, Meissner I, Brown RD Jr, Piepgras DG, Forbes GS, Thielen K, Nichols D, O’Fallon WM, Peacock J, Jaeger L, Kassell NF, Kongable-Beckman GL, Torner JC. : Unruptured intracranial aneurysms: natural history, clinical outcome, and risks of surgical and endovascular treatment. Lancet. 2003 Jul 12;362(9378):103-10.
- UCAS Japan Investigators, Morita A, Kirino T, Hashi K, Aoki N, Fukuhara S, Hashimoto N, Nakayama T, Sakai M, Teramoto A, Tominari S, Yoshimoto T.: The natural course of unruptured cerebral aneurysms in a Japanese cohort. N Engl J Med 2012; 366:2474-2482.
- Greving JP, Wermer MJ, Brown RD Jr, Morita A, Juvela S, Yonekura M, Ishibashi T, Torner JC, Nakayama T, Rinkel GJ, Algra A. : Development of the PHASES score for prediction of risk of rupture of intracranial aneurysms: a pooled analysis of six prospective cohort studies. Lancet Neurol.2014 Jan;13(1):59-66.
- Rinkel GJ, Djibuti M, Algra A, van Gijn J.: Prevalence and risk of rupture of intracranial aneurysms: a systematic review. Stroke. 1998 Jan;29(1):251-6.
- Unruptured intracranial aneurysms–risk of rupture and risks of surgical intervention. International Study of Unruptured Intracranial Aneurysms Investigators. N Engl J Med. 1998 Dec 10;339(24):1725-33.
- Brown RD Jr, Huston J, Hornung R, Foroud T, Kallmes DF, Kleindorfer D, Meissner I, Woo D, Sauerbeck L, Broderick J. .: Screening for brain aneurysm in the Familial Intracranial Aneurysm study: frequency and predictors of lesion detection. J Neurosurg. 2008 Jun;108(6):1132-8.
- de Rooij NK, Linn FH, van der Plas JA, Algra A, Rinkel GJ .: Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends. J Neurol Neurosurg Psychiatry. 2007 Dec; 78(12): 1365–1372.
- Molyneux A, Kerr R, Stratton I, Sandercock P, Clarke M, Shrimpton J, Holman R; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group.: International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet2002 Oct 26;360(9342):1267-74.
- Nieuwkamp DJ, Setz LE, Algra A, Linn FH, de Rooij NK, Rinkel GJ. : Changes in case fatality of aneurysmal subarachnoid haemorrhage over time, according to age, sex, and region: a meta-analysis. Lancet Neurol. 2009 Jul;8(7):635-42.
- van Gijn J., Rinkel G.J.: Subarachnoid haemorrhage: diagnosis, causes and management. Brain 2001; 124:249-278.
- Bracard S, Lebedinsky A, Anxionnat R, Neto JM, Audibert G, Long Y, Picard L.: Endovascular treatment of Hunt and Hess grade IV and V aneuryms. AJNR Am J Neuroradiol. 2002 Jun-Jul;23(6):953-7.
- Dammert S, Krings T, Moller-Hartmann W, Ueffing E, Hans FJ, Willmes K, Mull M, Thron A.: Detection of intracranial aneurysms with multislice CT: comparison with conventional angiography. Neuroradiology. 2004 Jun;46(6):427-34.
- Weir B.: Unruptured intracranial aneurysms: a review.J Neurosurg. 2002 Jan;96(1):64.
- Molyneux AJ, Kerr RS, Yu LM, Clarke M, Sneade M, Yarnold JA, Sandercock P; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group.: International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion. Lancet. 2005 Sep 3-9;366(9488):809-17.
- Molyneux A, Kerr R, Stratton I, Sandercock P, Clarke M, Shrimpton J, Holman R; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group.: International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet2002 Oct 26;360(9342):1267-74.
- Connolly ES Jr, Rabinstein AA, Carhuapoma JR, Derdeyn CP, Dion J, Higashida RT, Hoh BL, Kirkness CJ, Naidech AM, Ogilvy CS, Patel AB, Thompson BG, Vespa P; American Heart Association Stroke Council; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Nursing; Council on Cardiovascular Surgery and Anesthesia; Council on Clinical Cardiology. : Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2012 Jun;43(6):1711-37.
- Molyneux AJ, Birks J, Clarke A, Sneade M, Kerr RS.: The durability of endovascular coiling versus neurosurgical clipping of ruptured cerebral aneurysms: 18 year follow-up of the UK cohort of the International Subarachnoid Aneurysm Trial (ISAT). Lancet. 2015 Feb 21;385(9969):691-7.
- Molyneux AJ, Kerr RS, Birks J, Ramzi N, Yarnold J, Sneade M, Rischmiller J: Risk of recurrent subarachnoid haemorrhage, death, or dependence and standardised mortality ratios after clipping or coiling of an intracranial aneurysm in the International Subarachnoid Aneurysm Trial (ISAT): long-term follow-up. Lancet Neurol 2009 May;8(5):427-3.
- Pierot L, Cognard C, Anxionnat R, Ricolfi F; CLARITY Investigators.: Remodeling technique for endovascular treatment of ruptured intracranial aneurysms had a higher rate of adequate postoperative occlusion than did conventional coil embolization with comparable safety. Radiology. 2011 Feb;258(2):546-53.
- Pierot L, Spelle L, Leclerc X, Cognard C, Bonafé A, Moret J.: Endovascular treatment of unruptured intracranial aneurysms: comparison of safety of remodeling technique and standard treatment with coils. Radiology. 2009 Jun;251(3):846-55.
- Pierot L, Cognard C, Spelle L, Moret J.: Safety and efficacy of balloon remodeling technique during endovascular treatment of intracranial aneurysms: critical review of the literature. AJNR Am J Neuroradiol. 2012 Jan;33(1):12-5.
- Roy D, Milot G, Raymond J.: Endovascular treatment of unruptured aneurysms. Stroke. 2001 Sep;32(9):1998-2004.
- Santillan A, Gobin YP, Greenberg ED, Leng LZ, Riina HA, Stieg PE, Patsalides A.: Intraprocedural aneurysmal rupture during coil embolization of brain aneurysms: role of balloon-assisted coiling. AJNR Am J Neuroradiol. 2012 Nov;33(10):2017-21.
- Piotin M, Blanc R, Spelle L, Mounayer C, Piantino R, Schmidt PJ, Moret J. : Stent-assisted coiling of intracranial aneurysms: clinical and angiographic results in 216 consecutive aneurysms. Stroke. 2010 Jan;41(1):110-5.
- Henkes H, Bose A, Felber S, Miloslavski E, Berg-Dammer E, Kühne D. : Endovascular coil occlusion of intracranial aneurysms assisted by a novel self-expandable nitinol microstent (neuroform). Interv Neuroradiol. 2002 Jun 30;8(2):107-19
- Nishido H, Piotin M, Bartolini B, Pistocchi S, Redjem H, Blanc R.: Analysis of complications and recurrences of aneurysm coiling with special emphasis on the stent-assisted technique. AJNR Am J Neuroradiol. 2014 Feb;35(2):339-44.
embolizacja
Dowiedz się na czym polega leczenie przeznaczyniowe tętniaka wewnątrzczaszkowego oraz jakie powikłania ci grożą.
