metoda przeznaczyniowa
embolizacja
wad naczyń wewnątrzczaszkowych
7,4 %
procent redukcji ryzyka negatywnego zakończenia terapii przy leczeniu przeznaczyniowym względem metod chirurgicznych
Embolizacja - Jakie powikłania mi grożą?
Dwoma najczęstszymi rodzajami powikłań leczenia endowaskularnego tętniaków wewnątrzczaszkowych są powikłania zakrzepowo-zatorowe oraz śródzabiegowe pęknięcie tętniaka. Pierwsze z nich mogą powstać w efekcie formowania się skrzepliny w tętnicy, w miejscu kontaktu z czołem wprowadzonych spiral, z wystającym z tętniaka do światła naczynia fragmentem spirali lub na powierzchni mikrocewników używanych w trakcie procedury. Czynnikami zwiększającymi ryzyko powikłań zakrzepowo-zatorowych są: średnica tętniaka powyżej 10mm, palenie tytoniu oraz szeroka szyja tętniaka. Z uwagi na odmienną sytuację kliniczną częstość zdarzeń niepożądanych w trakcie leczenia różni się istotnie dla pacjentów z tętniakiem niepękniętym oraz krwawieniem podpajęczynówkowym. Odsetek powikłań zakrzepowo-zatorowych dla pierwszych z nich obliczono na 5,9%. W grupie pacjentów z SAH był on wyraźnie wyższy (12,4%).
Do pęknięcia tętniaka i związanego z nim krwawienia dochodzi u 2,6% pacjentów leczonych w trybie planowym oraz w 4,3% przypadków SAH. Jest ono efektem perforacji ściany tętniaka spiralą, mikroprowadnikiem lub mikrocewnikiem. Do ponownego krwawienia z tętniaka pękniętego może też dojść na skutek nadmiernego zwiększenia ciśnienia w jego świetle w trakcie embolizacji czy uszkodzenia skrzepu i odsłonięcia miejsca pierwotnego pęknięcia.
Łączne ryzyko powikłań okołozabiegowych oszacowano na 11,2% w grupie pacjentów z tętniakiem natywnym oraz 17,4% wśród chorych z krwawieniem podpajęczynówkowym. Śmiertelność związana z niekorzystnym przebiegiem zabiegu wyniosła w obu tych grupach około 1% .
Chcielibyśmy zwrócić Twoją uwagę, iż prezentowane powyżej dane statystyczne są danymi literaturowymi opartymi o badania sprzed co najmniej kilku – kilkunastu lat. Można stwierdzić, że w efekcie rozwoju metod embolizacji, postępu technologicznego stosowanego sprzętu oraz wzrostu doświadczenia lekarzy przeprowadzających zabiegi obecne ryzyko okołooperacyjne jest niższe. Bezsprzecznie jednak ryzyko to nadal jest wyższe od zera.
czy embolizację zawsze wykonujemy tak samo?
Naturalnie nie. W pierwszej fazie stosowania technik przeznaczyniowych notowano wysoki odsetek nawrotów tętniaka po embolizacji (tzw. rekanalizacja tętniaka) i związanej z tym konieczności powtórnego leczenia. Głównym powodem nawrotów było niewystarczające wypełnienie worka tętniaka spiralami embolizacyjnymi (zobacz rysunek poniżej). Fakt ten stał się jednym z głównych motorów napędowych rozwoju technologicznego sprzętu wykorzystywanego w leczeniu endowaskularnym, jak również nieustających poszukiwań technik embolizacji trwalszych i skuteczniejszych niż metoda klasyczna.

Rysunek 4. Skala Raymonda. Stopień 1 – tętniak całkowicie wypełniony; stopień 2 – resztkowa szyja tętniaka; stopień 3 – tętniak resztkowy . Kolorem czarnym oznaczono przepływającą krew.
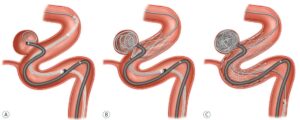
Dodatkowe wyzwanie stanowiły tętniaki wewnątrzczaszkowe o szerokiej szyi (szeroka szyja w uproszczeniu oznacza szerokie połączenie tętniaka z tętnicą macierzystą) oraz tętniaki zlokalizowane w podziale tętnicy. Pierwotnie znajdowały się one praktycznie poza zasięgiem metod przeznaczyniowych, z uwagi na podwyższone ryzyko wystawania spiral z worka tętniaka do naczynia macierzystego. Przełomem okazały się techniki remodelingu balonowego (BRT) oraz embolizacji z użyciem stentu (SACT). Główną ich ideę stanowi dodatkowy element podpierający i stabilizujący spirale w obrębie worka tętniaka – odpowiednio balon (napełniany tylko czasowo w trakcie embolizacji i usuwany w finalnym etapie zabiegu) lub stent jako element wprowadzany na stałe.
Rysunek 1. Zastosowanie jednego (a) lub dwóch (b) cewników balonowych w embolizacji tętniaka. Uwaga: W celu osiągnięcia większej przejrzystości rysunku nie umieszczono na nim spiral w worku tętniaka.
Balon umieszczony na przebiegu szyi tętniaka odgrywa niebagatelną rolę w przypadku pęknięcia tętniaka podczas zabiegu. Bezzwłoczne wypełnienie balonu pozwala natychmiast zatrzymać krwawienie i uzyskać dodatkowy czas na embolizację tętniaka zabezpieczając pacjenta przed masywniejszym krwotokiem. Wykazano, iż w sytuacji śródzabiegowego krwawienia z tętniaka zastosowanie balonu wiąże się ze zdecydowanie wyższym prawdopodobieństwem niezmienionego lub lepszego niż wyjściowy stanu klinicznego chorego w porównaniu do techniki klasycznej.
Dlaczego stosujemy stenty wewnątrzczaszkowe i co się z tym wiąże?
Możesz sobie wyobrazić stent (zakładając, że dotąd go nie widziałeś) jako coś zbliżonego do bardziej gęstej sprężynki długopisu.
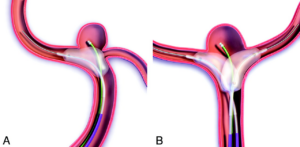
Rysunek 2. Zastosowanie stentu w embolizacji tętniaka (SACT).
Pacjenci, u których planowany jest zabieg wszczepienia stentu wewnątrzczaszkowego wymagają odpowiedniego przygotowania lekami hamującymi czynność płytek krwi (tzw. leki przeciwpłytkowe), by zminimalizować ryzyko wystąpienia zakrzepicy w stencie. W większości ośrodków stosuje się klopidogrel (najczęściej Plavix) i aspirynę (Acard) w dawce 75mg na dobę przez pięć do dziesięciu dni przed procedurą SACT, które następnie kontynuowane są przez co najmniej trzy miesiące po zabiegu. Przyjmowanie Acardu zaleca się pacjentowi przez kolejnych dziewięć miesięcy, a nawet przez całe życie. Znacznie trudniejszym wyzwaniem klinicznym jest decyzja o wszczepieniu stentu u pacjenta z ostrym krwawieniem podpajęczynówkowym. W powyższej sytuacji zdecydowana większość operatorów stosuje tę metodę leczenia w sytuacji bezwzględnej konieczności.
Rola stentu w embolizacji jest wielowymiarowa. Jak wspomnieliśmy wcześniej stanowi on element stabilizujący i podpierający spirale wprowadzone do worka tętniaka. Zapewnia również rusztowanie dla rozrostu śródbłonka (tj. wewnętrznej warstwy ściany tętnicy) „pełznącego” ze ściany naczyniowej na elementy struktury stentu oraz zmienia charakterystykę napływu krwi do tętniaka, wspomagając proces wykrzepiania krwi w jego worku.
Wykazano, że dodatkowe użycie stentu przy embolizacji spiralami jest najistotniejszym czynnikiem redukującym ilość angiograficznie potwierdzonych nawrotów tętniaka. Jednakże należy zwrócić uwagę, iż SACT jest techniką nieco trudniejszą niż embolizacja klasyczna czy remodeling balonowy, wymagającą pewnego doświadczenia w implantacji stentów wewnątrzczaszkowych, a co za tym idzie niosącą umiarkowanie wyższe ryzyko powikłań związanych z zabiegiem, zarówno zakrzepowych jak i krwotocznych.
Czym jest proteza kierunkująca przepływ?
Kolejną odsłoną idei stentów wewnątrzczaszkowych są protezy kierunkujące przepływ (ang. flow diverter, FD). Są to gęsto plecione stenty, w których pokrycie metalem stanowi około 30% ich powierzchni. Taka konstrukcja powoduje, iż ich wszczepienie do tętnicy na przebiegu szyi tętniaka zapewnia istotny stopień przekierowania przepływu krwi przez protezę do dystalnych odcinków naczynia oraz ograniczenie napływu krwi do tętniaka wraz ze zmianą charakterystyki tego napływu, co stymuluje krzepnięcie wewnątrz worka. Ponadto gęsta sieć metalowego utkania protezy zapewnia lepsze pokrycie szyi tętniaka ułatwiając jej odseparowanie od naczynia macierzystego.
W ostatnich latach częstość stosowania protez kierunkujących przepływ wyraźnie wzrosła (w tym w kombinacji ze spiralami embolizacyjnymi). Stoi za tym fakt, iż tętniak per se jest traktowany jako objaw choroby danego odcinka tętnicy a nie choroba sama w sobie. Wszczepiony do tętnicy stent, a tym bardziej proteza kierunkująca przepływ z czasem pokrywa się śródbłonkiem, ulega wbudowaniu w ścianę naczynia wzmacniając jego strukturę i przywracając prawidłowy kształt i funkcję tego odcinka tętnicy.
W przypadku przeważającej części tętniaków zaopatrywanych przez nas z użyciem protezy kierunkujące przepływ stosujemy tę protezę jako jedyny element leczenia, bez spiral embolizacyjnych. Pozwala to w zdecydowanej większości przypadków uzyskać efekt „kurczenia się” tętniaka aż do jego zniknięcia i całkowitego wyleczenia. Proces ten nie zachodzi jednak natychmiast tylko stopniowo i wymaga pewnego okresu czasu (szacuje się, iż zazwyczaj kilku miesięcy).